製品FAQ
製剤・安定性
- 製剤の安定性試験の結果は?
-
製剤の安定性試験の結果を以下に示します。
〈ルボックス®錠25・50〉
錠50よりも錠25の方がより保存条件の影響を受けやすいため、苛酷試験、長期保存試験は錠25についてのみ実施しました。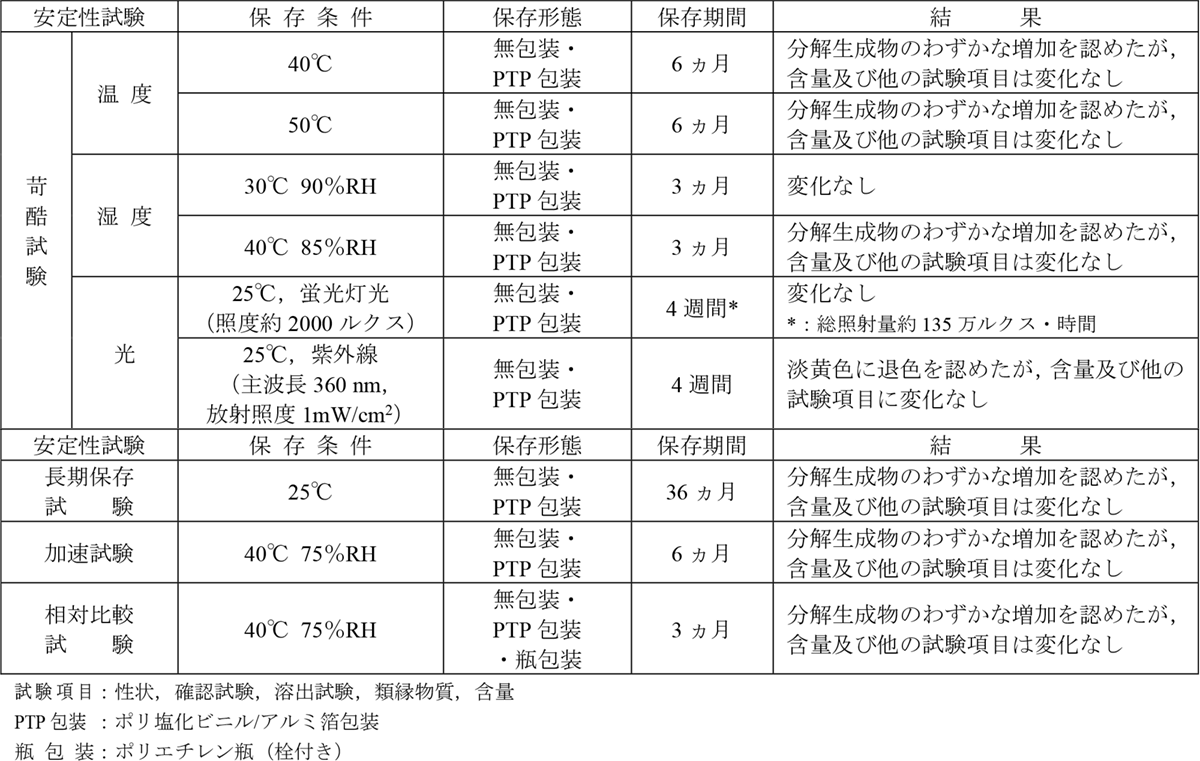
〈ルボックス®錠75〉
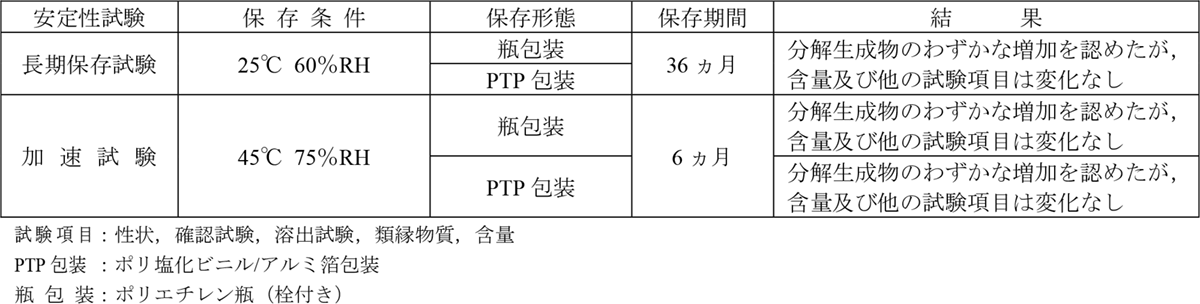
参考資料:
インタビューフォーム
- 開封後、一包化した場合の安定性は?
-
本剤を一包化した状態での安定性に関するデータはありません。
参考資料:
-
投与方法
- 簡易懸濁はできますか?
-
簡易懸濁により投与することは承認された用法用量ではありません。
アッヴィでは簡易懸濁での投与データを取得しておらず、有効性・安全性の検討は行っておりません。参考資料:
-
- 粉砕投与や半錠投与はできますか?
-
粉砕や半錠をして投与することは承認された用法用量ではありません。
アッヴィでは粉砕・半錠での投与データを取得しておらず、有効性・安全性の検討は行っておりません。また、本剤はフィルムコート錠のため、割錠したりかみ砕いたりすると、患者さんが苦味・舌のしびれを感じる可能性があります。
電子添文では、服用時に「十分な水とともに服用し、かみ砕かないよう指導すること。かみ砕くと苦みがあり、舌のしびれ感があらわれることがある。」と記載しています[1]。
また、インタビューフォームにおいて「フルボキサミンマレイン酸塩には、苦味があり、舌のしびれ感があらわれることがあるので粉砕は行わないこと。また、粉砕時には飛散による眼粘膜刺激性も懸念される。」と記載しています[2]。参考資料:
[1]電子添文
[2]インタビューフォーム
- 食事の影響を受けますか?
-
健康成人における試験で、本剤の吸収に食事の影響は認められませんでした。
<参考:食事・併用薬の影響>
健康成人12例(男性8例、女性4例)にルボックス®錠50mgを空腹時及び食後に経口投与したとき、血漿中濃度は投与後6-7時間で最高濃度に達した後、以下の曲線のように推移し、吸収に食事の影響は認められませんでした。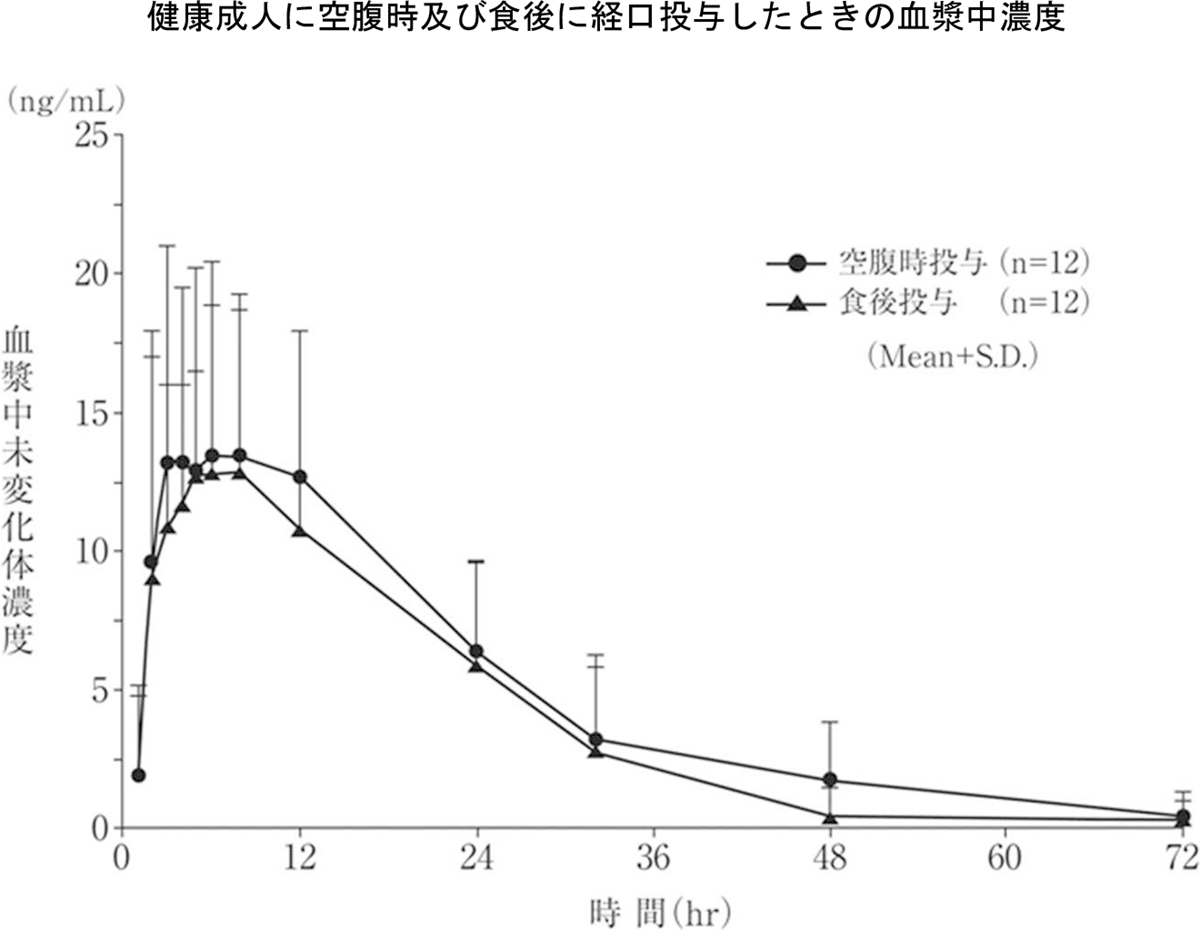

参考資料:
インタビューフォーム
特殊患者
- 腎機能障害患者・透析患者へ投与できますか?
-
電子添文では、重度の腎機能障害患者では排泄が遅延するおそれがあるとして、注意喚起をしています[1]。
本剤は肝で代謝されその主要代謝物には生理活性はほとんど認められず、海外で健康成人に14C-フルボキサミン1mg(n=1)又は5mg(n=5)を経口投与した試験では全放射能の平均で約94%が尿中に排泄され、また、健康成人に本剤100mg(n=6)又は200mg(n=6)を経口投与した試験では、約1%程度の未変化体が尿中に排泄されています。 このように本剤の排泄は腎を経由し、また、人工透析患者のようなより重篤な腎障害を有する患者に投与した場合の影響は明らかでないことから、本剤の海外での添付文書並びに他の抗うつ薬の添付文書を参考に設定しました[2]。
透析等による除去率については、本剤を1日50mg、28日反復経口投与した軽症うつ病の維持透析患者(n=3)において、血漿中フルボキサミン濃度は血液透析により約22%低下しました。また、血漿中アルブミン濃度が高いほどフルボキサミンの除去率は低い傾向を示しました[2][3]。
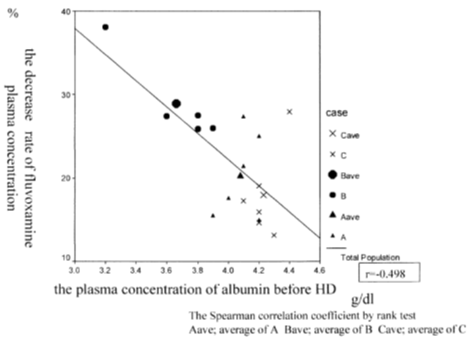
<参考:血漿蛋白結合率>
平衡透析法により測定したヒト血清蛋白との結合率は、外国人のデータでは、0.1μg/mLと0.5μg/mLの濃度で約81%であった(in vitro)。また、ヒト血漿蛋白結合率は70~76%であった(in vitro)[2]。参考資料:
[1]電子添文
[2]インタビューフォーム
[3]Kamo, T. et al. Efficacy and pharmacokinetics of fluvoxamine maleate in patients with mild depression undergoing hemodialysis:Psychiatry Clin. Neurosci., 58, 2: 133-137 (2004)
- 肝機能障害患者へ投与できますか?
-
肝機能障害患者ではAUCが増大又は半減期が延長するおそれがあるとして、電子添文で注意喚起をしています[1]。
海外の試験で肝硬変患者[ブロモスルフォフタレイン(ブロモサルファレイン:BSP)試験でのBSP消失速度定数0.029-0.107(min-1)(正常値≧0.14)、n=13]にフルボキサミン100mgを経口投与した場合、健康成人男子に投与した場合に比べて、最大血中濃度(Cmax)には差は認められませんでしたが、最大血中濃度到達時間(Tmax)の遅れ、消失半減期(t1/2)の延長及びAUCの増加が認められたことより、電子添文にて注意喚起をしています。[2]。
また、 AST、ALT、γ-GTP、総ビリルビン等の著しい上昇を伴う肝機能障害、黄疸(いずれも頻度不明)があらわれることがあることから、重大な副作用に設定しました。肝機能検査等の観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行ってください[1]。
項目別副作用頻度及び臨床検査値異常は以下の通りです(抜粋)[2]。●頻度
うつ病・うつ状態、強迫性障害(承認時/使用成績調査時)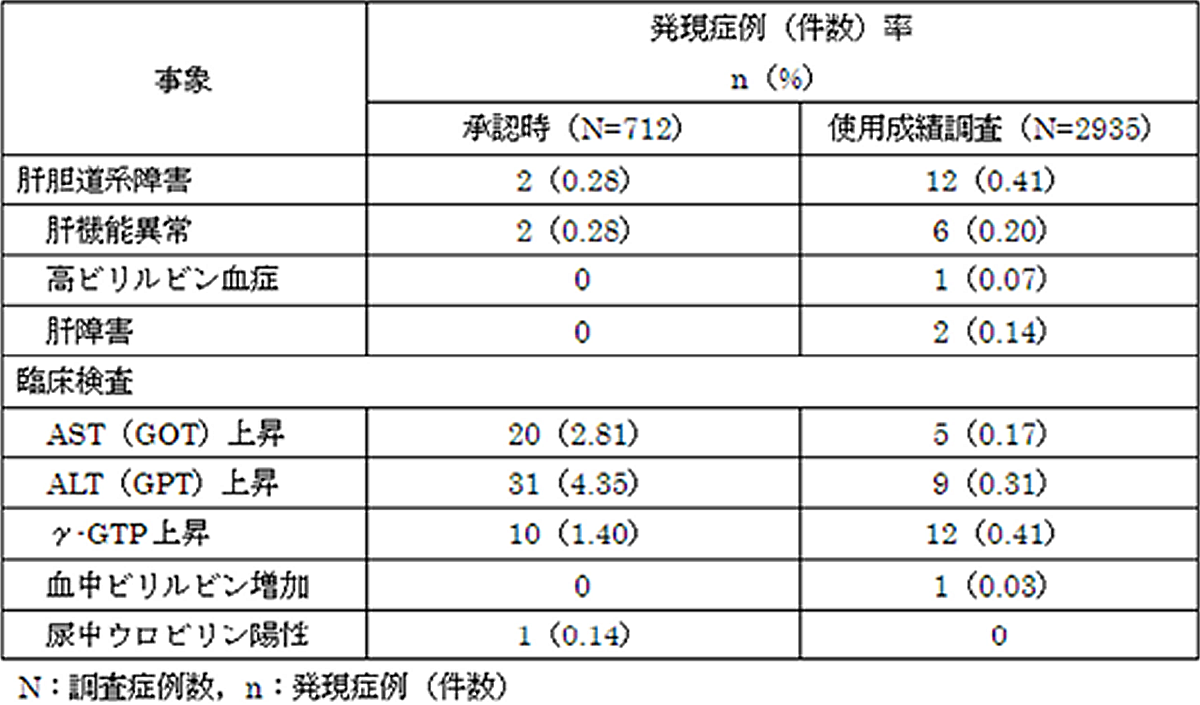
社会不安障害(効能追加承認時/特定使用成績調査時(長期))
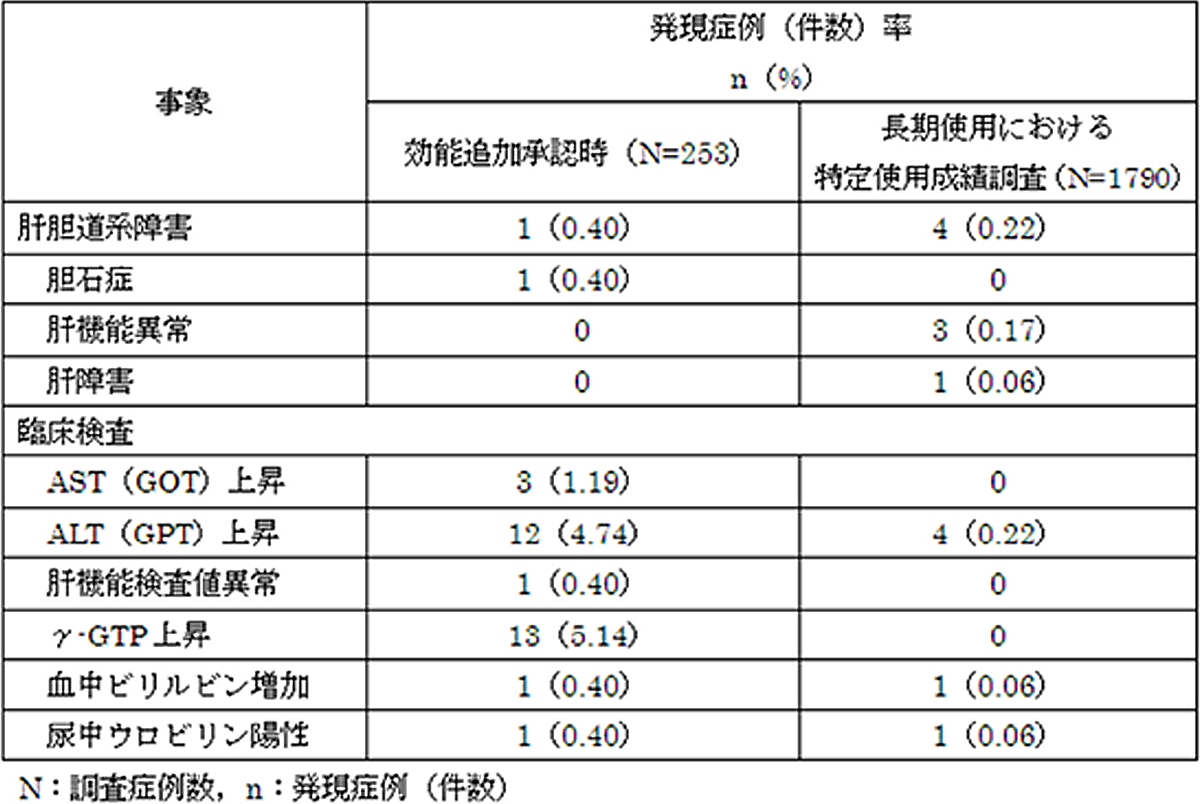
参考資料:
[1]電子添文
[2]インタビューフォーム
- 妊婦へ投与した場合、胎児への影響はどのくらいですか?
-
電子添文では、妊娠中の投与に関する安全性は確立していないことから、「妊婦又は妊娠している可能性のある女性には、投与しないことが望ましい。また、投与中に妊娠が判明した場合は投与を中止することが望ましい。」と記載しています[1]。
- 1)妊娠後期(第3三半期)に本剤を投与された妊婦から出生した新生児において、呼吸困難、振戦、筋緊張異常、痙攣、易刺激性、傾眠傾向、意識障害、嘔吐、哺乳困難、持続的な泣き等の症状が発現したとの報告があります。なお、これらの症状は、薬物離脱症状として報告される場合もあります[1]。
- 2)海外の疫学調査において、妊娠中に他のSSRIを投与された妊婦から出生した新生児において、新生児遷延性肺高血圧症のリスクが増加したとの報告があります。このうち1つの調査では、妊娠34週以降に生まれた新生児における新生児遷延性肺高血圧症発生のリスク比は、妊娠早期の投与では2.4(95%信頼区間1.2-4.3)、妊娠早期及び後期の投与では3.6(95%信頼区間1.2-8.3)でした[1]。
<参考:妊娠中の投与に関する安全性情報>
海外の疫学調査結果において、妊娠20週以降の妊婦にSSRIを投与した場合、出生した新生児では「新生児遷延性肺高血圧症(Persistent pulmonary hypertension of the newborn;PPHN)」のリスクが増加したとの報告がありました。その後、カナダ保健省により、SSRIを服用している女性及び妊婦又は妊娠を予定している女性に対し、新生児へのリスクがあることを医師と相談するようアドバイスが出されています。また、スウェーデンにおいて実施された疫学調査において、SSRIを服用した妊娠時期におけるPPHNの発症リスク比が報告されました[2]。<参考:胎児への移行性>
妊娠18日目のラットに14C-フルボキサミンを遊離体として5mg/kg経口投与したとき、投与後1時間における生殖器官の放射能濃度は卵巣では血漿中濃度の約2倍であり、子宮では血漿と同程度でした。胎盤、羊水中の放射能濃度は母動物の血漿中よりも低かった。胎児の全身の放射能濃度は母動物血漿の約1/5でした。また、胎児の組織内放射能濃度は胎児血液中よりも最大で約2倍高かったが消失は速やかで、投与後24時間には1時間値の約1/10~1/20に減少しました[2]。参考資料:
[1]電子添文
[2]インタビューフォーム
- 授乳婦へ投与できますか?乳汁移行はありますか?
-
電子添文では、「治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行することが報告されている。 」と記載しています[1]。
<参考:乳汁への移行性>
うつ病で分娩後12週間治療中の患者(23歳、70kg)1例で血漿中及び乳汁中濃度に関する報告(外国)があります。
採血・採乳前2週間、ルボックス®100mgを1日2回経口投与し、tmaxと推定される最終投与の約5時間後に採血・採乳して測定した結果、血漿中濃度0.31μg/mLに対して乳汁中濃度は0.09μg/mLでした[2]。参考資料:
[1]電子添文
[2]インタビューフォーム
- 高齢者に投与した際の薬物動態は?
-
高齢者への投与に関して、電子添文では以下の記載をしています[1]。
高い血中濃度が持続し、出血傾向の増強等がおこるおそれがあるので、増量に際しては、用量等に注意して慎重に投与すること。本剤は主として肝臓で代謝されるが、高齢者では肝機能が低下していることが多い。また、抗利尿ホルモン不適合分泌症候群は主に高齢者において報告されているので、注意すること。なお、因果関係は不明であるが、心疾患のある高齢者において、房室ブロック、心室頻拍等があらわれたとの報告がある。また、高齢者うつ病・うつ状態の患者における臨床試験で確認された血中濃度を以下に示します[2]。
<参考:高齢者うつ病・うつ状態患者>
高齢うつ病・うつ状態患者(65-93歳)に、フルボキサミンを初期用量50mg/日とし投与量を増減しながら1日2回28日間反復経口投与したところ、50mg/日維持症例の血清中濃度(trough値)は、健康成人の計算値(7.2ng/mL)と比べ高値を示しましたが、投与期間中ほぼ一定でした。
また、増量症例においては、その血清中濃度(trough値)は投与量の増加に伴い上昇を認めました。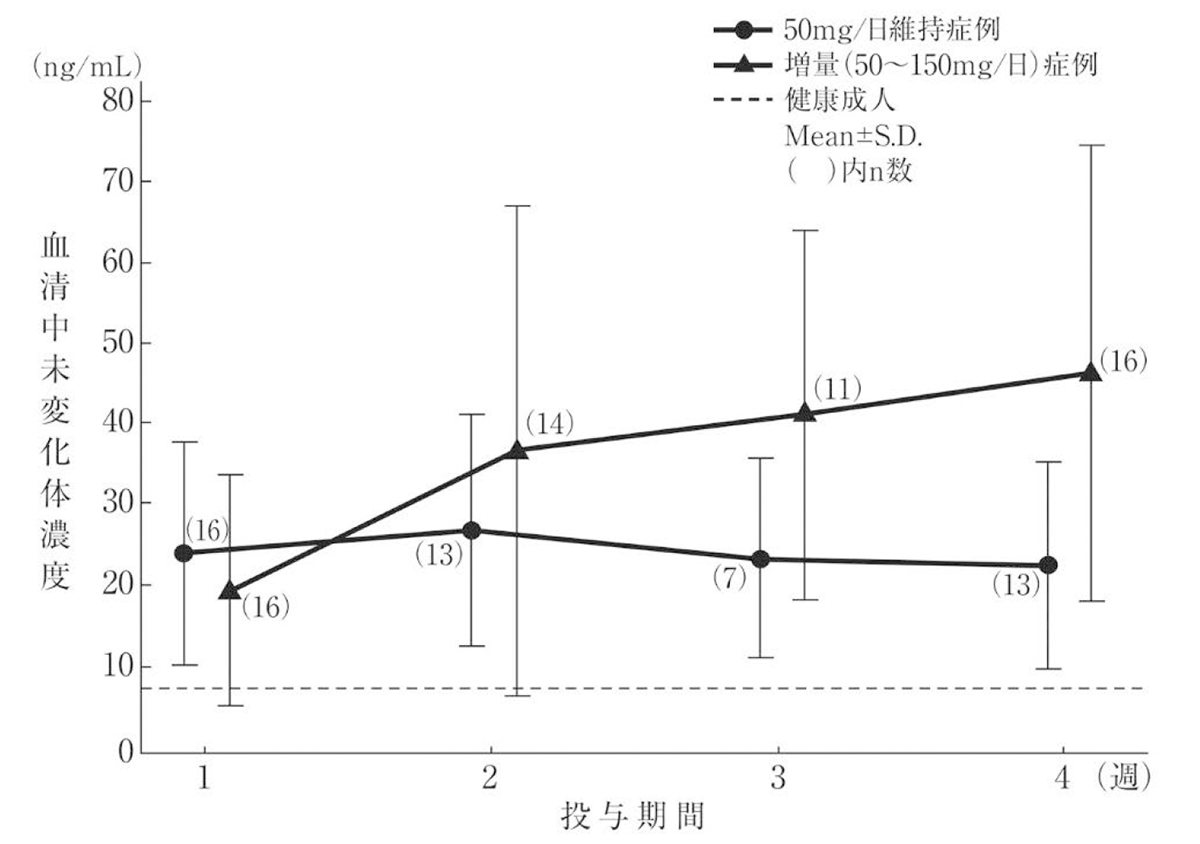
参考資料:
[1]電子添文
[2]インタビューフォーム
安全性
- 禁忌について
-
電子添文では、禁忌について以下の記載をしています。
【禁忌(次の患者には投与しないこと)】
- 1)本剤の成分に対し過敏症の既往歴のある患者
- 2)モノアミン酸化酵素(MAO)阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩、サフィナミドメシル酸塩)を投与中あるいは投与中止後2週間以内の患者
- 3)ピモジド、チザニジン塩酸塩、ラメルテオン、メラトニン を投与中の患者
参考資料:
電子添文
- 重要な基本的注意について
-
電子添文では、重要な基本的注意について以下の記載をしています。
【重要な基本的注意】
〈効能共通〉
- 1.眠気、意識レベルの低下・意識消失等の意識障害が起こることがあるので、本剤投与中の患者には、自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
- 2.うつ症状を呈する患者は希死念慮があり、自殺企図のおそれがあるので、このような患者は投与開始早期ならびに投与量を変更する際には患者の状態及び病態の変化を注意深く観察すること。
- 3.不安、焦燥、興奮、パニック発作、不眠、易刺激性、敵意、攻撃性、衝動性、アカシジア/精神運動不穏、軽躁、躁病等があらわれることが報告されている。また、因果関係は明らかではないが、これらの症状・行動を来した症例において、基礎疾患の悪化又は自殺念慮、自殺企図、他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに、これらの症状の増悪が観察された場合には、服薬量を増量せず、徐々に減量し、中止するなど適切な処置を行うこと。
- 4.自殺目的での過量服用を防ぐため、自殺傾向が認められる患者に処方する場合には、1回分の処方日数を最小限にとどめること。
- 5.家族等に自殺念慮や自殺企図、興奮、攻撃性、易刺激性等の行動の変化及び基礎疾患悪化があらわれるリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。
- 6.投与量の急激な減少ないし投与の中止により、頭痛、嘔気、めまい、不安感、不眠、集中力低下等があらわれることが報告されているので、投与を中止する場合には徐々に減量するなど慎重に行うこと。
〈強迫性障害(小児)〉
- 7.本剤投与により自殺念慮、自殺企図があらわれる可能性がある。本剤投与中は定期的に安全性及び有効性を評価し、漫然と投与しないこと。
参考資料:
電子添文
- 重大な副作用について
-
電子添文では、重大な副作用について以下の記載をしています。
【重大な副作用】
- 1.痙攣(頻度不明)、せん妄、錯乱、幻覚、妄想(各0.1~5%未満)
-
2.意識障害(頻度不明)
意識レベルの低下・意識消失等の意識障害があらわれることがある。 - 3.ショック、アナフィラキシー(いずれも頻度不明)
-
4.セロトニン症候群(頻度不明)
錯乱、発熱、ミオクロヌス、振戦、協調異常、発汗等が発現した場合は投与を中止し、水分補給等の全身管理とともに適切な処置を行うこと。なお、セロトニン作用薬との併用において、昏睡状態となり、急性腎障害へと移行し、死亡した例が報告されている。 -
5.悪性症候群(頻度不明)
向精神薬(抗精神病薬、抗うつ薬等)との併用により、無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎障害へと移行し、死亡した例が報告されている。 -
6.白血球減少、血小板減少(いずれも頻度不明)
血液検査等の観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 -
7.肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、総ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがあるので、肝機能検査等の観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 -
8.抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム増加、高張尿、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがあるので、食欲不振、頭痛、嘔気、嘔吐、全身倦怠感等があらわれた場合には電解質の測定を行い、異常が認められた場合には、投与を中止し、水分摂取の制限等の適切な処置を行うこと。
参考資料:
電子添文
- 相互作用について
-
電子添文では、相互作用について以下の記載をしています。
【相互作用】
本剤の代謝には肝薬物代謝酵素CYP2D6が関与していると考えられている。また、本剤は肝薬物代謝酵素のうちCYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4を阻害し、特にCYP1A2、CYP2C19の阻害作用は強いと考えられている。【併用禁忌(併用しないこと)】

【併用注意(併用に注意すること)】

参考資料:
電子添文
2024年7月掲載
JP-LUVO-200053-5.0
製品についてのお問い合わせ
弊社医療用医薬品に関するお問い合わせは、下記“くすり相談室”へお電話またはお問い合わせフォームへご連絡下さい。
- くすり相談室
-
0120-587-874受付時間:9時~17時30分
(土日・祝日、当社休日を除く)
-
インターネットでのお問い合わせは
こちらから - お問い合わせフォーム

